-
 金属 金属腐蚀与防护
金属 金属腐蚀与防护
 金属 金属腐蚀与防护
金属 金属腐蚀与防护
金属腐蚀是指金属和周围环境中(介质)之间发生化学或电化学反应,从而引发的破坏或变质。金属腐蚀现象普遍存在于国民经济和国防建设各个领域,危害相当严重。
1、金属腐蚀的原因
金属在与空气和水进行接触的过程中容易出现被腐蚀的现象,这就导致金属失去了原有的强度和性能,不能正常使用。
金属腐蚀是一种常见的化学反应现象,它是金属在遇到氧和水后产生的氧化还原反应。这一化学反应完全导致了金属结构的变化,金属结构出现了变化,失去了原有的性能。由于金属的氧化还原反应是持续的,直到金属被完全腐蚀掉彻底的改变性能,从而会导致严重的事故。
2、金属腐蚀的分类
金属腐蚀的发生主要是在环境的影响下所导致的破坏和变质。根据金属腐蚀过程来划分,主要包含化学腐蚀、电化学腐蚀以及物理腐蚀;根据腐蚀的条件来划分。ZD包含高温腐蚀与常温腐蚀;干腐蚀与湿腐蚀等。
3、金属腐蚀的影响因素
①空气相对湿度与金属腐蚀的临界相对湿度。空气内的氧气总是比较充足的,金属腐蚀反应的速率ZD是基于水分的产生,假如到达或者超越特定的相对湿度,金属腐蚀就会以较快的速度出现和恶化,通常而言,钢铁的临界相对湿度大概是75%。
②空气中污染性物质的影响。通常能够见到的为SO2,CO2,Cl-,灰尘等,多数皆为酸性气体。
③温度。环境温度和变化规律影响金属表面水份凝聚及电化学腐蚀反应速率。
④酸碱盐。ZD体现在影响水膜电解质浓度与H+浓度,进而加快腐蚀的速度。
1、化学腐蚀
化学腐蚀是指金属表面与非电解质直接发生纯化学作用而引起的破坏。其反应历程的特点是金属表面的原子与非电解质中的氧化剂直接发生氧化还原反应,形成金属腐蚀产物。
金属腐蚀过程中电子的传递是在金属与氧化剂之间直接进行的,因而没有电流产生。纯化学腐蚀的情况并不多。主要为金属在无水的有机液体和气体中腐蚀以及在干燥气体中的腐蚀。
金属的高温氧化,在50年代前一直作为化学腐蚀的典型例子,但1952年瓦格纳(CWagner)根据氧化膜的近代观点提出,高温气体中金属的氧化Z初虽是通过化学反应,但随后膜的生长过程则属于电化学机理。这是因为此时金属表面的介质已由气相改变为既能电子导电,又能离子导电的半导体氧化膜。
金属可在阳极(金属/膜界面)离解后,通过膜把电子传递给膜表面上的氧,使其还原变成氧离子(O2-),而氧离子和金属离子在膜中又可进行离子导电,即氧离子向阳极(金属/膜界面)迁移和金属离子向阴极(膜/气相界面)迁移,或在膜中某处进行第二次化合。所有这些均已划入电化学腐蚀机理的范畴,故现在已不再把金属的高温氧化视为单纯的化学腐蚀了。
2、电化学腐蚀
电化学腐蚀是指金属表面与离子导电的介质(电解质)发生电化学反应而引起的破坏。任何以电化学机理进行的腐蚀反应至少包含有一个阳极反应和一个阴极反应,并以流过金属内部的电子流和介质中的离子流形成回路。
阳极反应是氧化过程,即金属离子从金属转移到介质中并放出电子;阴极反应为还原过程,即介质中的氧化剂组分吸收来自阳极的电子的过程。例如,碳钢在酸中腐蚀时,在阳极区铁被氧化为Fe2+离子,所放出的电子由阳极(Fe)流至钢中的阴极(Fe3C)上被H+离子吸收而还原成氢气,即
阳极反应:Fe→Fe2++2e
阴极反应:2H++2e→H2↑
总反应:Fe+2H+→Fe2++H2↑
可见,与化学腐蚀不同,电化学腐蚀的特点在于,它的腐蚀历程可分为两个相对独立并可同时进行的过程。由于在被腐蚀的金属表面上存在着在空间或时间上分开的阳极区和阴极区,腐蚀反应过程中电子的传递可通过金属从阳极区流向阴极区,其结果必有电流产生。这种因电化学腐蚀而产生的电流与反应物质的转移,可通过法拉第定律定量地联系起来。
由上述电化学机理可知,金属的电化学腐蚀实质上是短路的电偶电池作用的结果。这种原电池称为腐蚀电池。电化学腐蚀是Z普遍、Z常见的腐蚀。金属在大气、海水、土壤和各种电解质溶液中的腐蚀都属此类。
电化学作用既可单独引起金属腐蚀,又可和机械作用、生物作用共同导致金属腐蚀。当金属同时受拉伸应力和电化学作用时,可引起应力腐蚀断裂。金属在交变应力和电化学共同作用下,可产生腐蚀疲劳。若金属同时受到机械磨损和电化学作用,则可引起磨损腐蚀。微生物的新陈代谢可为电化学腐蚀创造条件,参与或促进金属的电化学腐蚀,称为微生物腐蚀,或称细菌腐蚀。
3、物理腐蚀
物理腐蚀是指金属由于单纯的物理溶解作用引起的破坏。熔融金属中的腐蚀就是固态金属与熔融液态金属(如铅、锌、钠、汞等)相接触引起的金属溶解或开裂。这种腐蚀不是由化学反应,而是由于物理溶解作用,形成合金,或液态金属渗入晶界造成的。例如,热浸锌用的铁锅,由于液态锌的溶解作用,可使铁锅很快腐蚀坏。
金属腐蚀给带来严重损失,全世界每年金属总产量的20-40%的被腐蚀损耗。世界各国因腐蚀而造成的经济损失远超过其它各种自然灾害引起的经济损失的总和。工业发达国家每年因为金属腐蚀造成的经济损失占国发生产总值的2-4%,如果再加上因金属腐蚀而造成的停工和事故等间接损失,数字将会更加惊人。
我国上世纪80年代初对化工机械等行业调查表明,腐蚀造成的损失约占当年生产总值的4%,如各类机械设备及建筑构筑物的使用年限极大缩短,造成不必要的二次投资,使用安全存在严重的风险,造成使用及维护成本的极大浪费。
化学工业、石油化工、机械、农药、原子能等工业中,由于金属腐蚀造成设备的跑、冒、滴、漏,不仅造成惊人的经济损失,还可能使许多有毒物质甚至放射性物质泄漏而污染环境,危害人民的健康,有的甚至会长期造成严重的后果;而由于金属腐蚀所造成的灾难性事故严重地威胁着人们的生命安全。
根据2003年发表的ZG腐蚀调查报告,我国年腐蚀损失约占国民生产总值的5%,其中25%是能避免的,腐蚀所造成的经济损失约为每年5000亿元。随着我国经济的快速发展,2010年我国国民经济总值为397983亿元人民币,每年因腐蚀而引起的损失约10000亿元人民币。因此,加强金属的防腐保护具有重要意义。
金属腐蚀的防护方式具有多样性,ZD对象为金属本质,将被保护金属和腐蚀介质进行隔离,或者对金属的表面进行操作,改变腐蚀条件和电化学保护等。
1、改善金属本质
按照差异性的用途采取差异性的材料构成耐蚀合金,或者于金属内加入合金元素,提升它的耐腐蚀性,能够预防或者降低金属腐蚀的速度。比方,于钢内融入镍制成不锈钢能够强化防腐蚀等级。
2、构成保护层
于金属表面设置各类保护层,将被保护的对象和腐蚀性介质进行隔离,此为预防金属腐蚀的Z佳方式。
①金属的磷化处理
在钢铁制品去油、除锈操作之后,添加一定组成的磷酸盐溶液中浸泡,就能够在金属表面产生一层不溶于水的磷酸盐薄膜,此类过程即为磷化操作。磷化膜表现为暗灰色到黑灰色,厚度通常是5至20μm之间,于空气内具备较强的耐腐蚀能力。
②金属的氧化处理
把钢铁制品融入至NaOH的混合溶液内,加热,在它的表面就能够产生一层厚是0.5~1.5μm的蓝色氧化膜(主要组分是Fe3O4),来实现钢铁防腐蚀的目标,这个过程就叫做发蓝处理。此类氧化膜具备较强的弹性与润滑度,不会对零件的精度产生任何负面的作用。因此精密仪器与光学元件等通常选择这种操作。
③非金属涂层
通过非金属比如油漆、喷漆、沥青等涂抹于金属表层产生保护层,叫做非金属涂层,亦能够实现防腐蚀的目标。比如船身、车厢、水桶等通常选择油漆,车辆的表面经常喷漆等。
④金属保护层
其为将一类耐腐蚀能力较大的金属或者合金镀于保护对象的表层上所产生的保护镀层。此镀层的产生,不仅可以通过电镀、化学镀实现,还能够通过热浸镀、渗镀、真空镀等方式实现。
3、改善腐蚀条件
改善条件对于降低与避免腐蚀具有必要性。比如,能够选择在腐蚀介质内融入可以减小腐蚀速度的物质,也就是缓冲剂,来降低与避免腐蚀的发生。缓冲剂属于一类化学物质,将其适量的融入至腐蚀介质内,即能够大幅度降低金属腐蚀的速度。因为缓冲剂的用量较小,便捷和廉价,因此这也是一类十分重要的防腐蚀方式。
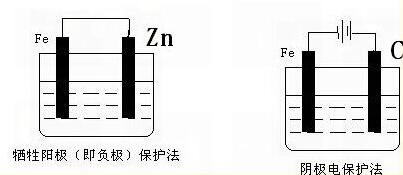
4、电化学保护法
此类方式为以电化学原理为基础的,于金属设备上进行操作,让其变成腐蚀电池中的阴极,进而成为预防或者减缓金属腐蚀的方式。
此外通过外加电源来保护金属。将保护的对象接于负极,变成阴极防止腐蚀的产生。同时选择部分铁块接于正极,让其变成阳极,使其腐蚀,也就是说牺牲阳极。此类方式ZD应用于化工厂的部分酸性溶液贮槽或者管道,地下水管、输油管等。
①本文由仪器网入驻的作者或注册的会员撰写并发布,观点仅代表作者本人,不代表仪器网立场。若内容侵犯到您的合法权益,请及时告诉,我们立即通知作者,并马上删除。
②凡本网注明"来源:仪器网"的所有作品,版权均属于仪器网,转载时须经本网同意,并请注明仪器网(www.yiqi.com)。
③本网转载并注明来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
④若本站内容侵犯到您的合法权益,请及时告诉,我们马上修改或删除。邮箱:hezou_yiqi